Il existe aujourd’hui des centaines de ces substances chimiques liées au cannabis, tant naturelles que synthétiques, qui inspirent les chercheurs en quête de percées médicales.
Les années 1960 ont été une grande décennie pour le cannabis : Les images du flower power, de l’été de l’amour et de Woodstock ne seraient pas complètes sans un joint accroché à la bouche de quelqu’un. Pourtant, au début des années 60, les scientifiques en savaient étonnamment peu sur cette plante. Lorsque Raphael Mechoulam, alors jeune chimiste d’une trentaine d’années à l’Institut Weizmann des sciences d’Israël, s’est mis en quête de produits naturels intéressants à étudier, il a constaté une lacune séduisante dans les connaissances sur l’herbe des hippies : La structure chimique de ses ingrédients actifs n’avait pas encore été déterminée.
M. Mechoulam s’est mis au travail.
Le premier obstacle a été de mettre la main sur du cannabis, étant donné qu’il était illégal. « J’ai eu de la chance », raconte Mechoulam dans une chronique personnelle de l’œuvre de sa vie, publiée ce mois-ci dans l’Annual Review of Pharmacology and Toxicology. « Le responsable administratif de mon institut connaissait un officier de police. … Je me suis simplement rendu au quartier général de la police, j’ai pris une tasse de café avec le policier chargé du stockage des drogues illicites, et j’ai obtenu 5 kg de haschisch confisqué, vraisemblablement passé en contrebande depuis le Liban. »
En 1964, Mechoulam et ses collègues avaient déterminé, pour la première fois, la structure complète du delta-9-tétrahydrocannabinol, mieux connu sous le nom de THC (responsable du « high » psychoactif de la marijuana) et du cannabidiol, ou CBD.
Ce coup de génie chimique a ouvert la voie à la recherche sur le cannabis. Au cours des décennies suivantes, des chercheurs, dont M. Mechoulam, ont identifié plus de 140 composés actifs, appelés cannabinoïdes, dans la plante de cannabis, et ont appris à en fabriquer beaucoup en laboratoire. Mechoulam a aidé à comprendre que le corps humain produit ses propres versions naturelles de substances chimiques similaires, appelées endocannabinoïdes, qui peuvent façonner notre humeur et même notre personnalité. Et les scientifiques ont maintenant fabriqué des centaines de nouveaux cannabinoïdes synthétiques, dont certains sont plus puissants que tout ce que l’on trouve dans la nature.
Aujourd’hui, les chercheurs exploitent l’énorme quantité de cannabinoïdes connus – anciens et nouveaux, trouvés dans les plantes ou chez les humains, naturels et synthétiques – pour d’éventuelles utilisations pharmaceutiques. Mais, dans le même temps, les cannabinoïdes synthétiques sont devenus une tendance forte des drogues récréatives, avec des effets potentiellement dévastateurs.
Pour la plupart des cannabinoïdes synthétiques fabriqués jusqu’à présent, les effets indésirables l’emportent généralement sur leurs utilisations médicales, explique le biologiste João Pedro Silva, de l’université de Porto, au Portugal, qui étudie la toxicologie de l’abus de substances et qui est coauteur d’une évaluation des avantages et des inconvénients de ces médicaments parue en 2023 dans l’Annual Review of Pharmacology and Toxicology. Mais, ajoute-t-il, cela ne signifie pas qu’il n’y a pas de meilleures choses à venir.
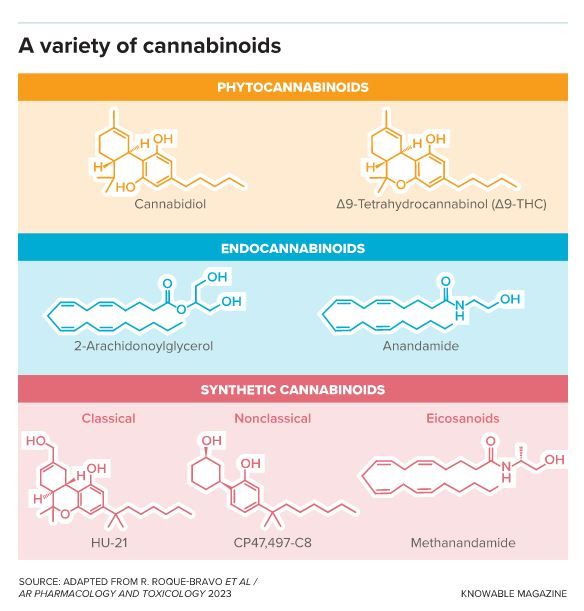
La plante de cannabis produit plus de 140 phytocannabinoïdes, dont les plus connus sont le cannabidiol (CBD) et le delta-9-tétrahydrocannabinol (THC) (en haut). Malgré leurs différences chimiques, ils interagissent avec bon nombre des mêmes récepteurs que les composés fabriqués par l’organisme, appelés endocannabinoïdes (au milieu). Les composés synthétiques (en bas, trois représentés) qui sont censés imiter l’action des différents cannabinoïdes ont également une grande variété de structures chimiques.
La longue histoire médicale du cannabis
Le cannabis est utilisé depuis des siècles pour toutes sortes de raisons, qu’il s’agisse d’écraser l’anxiété ou la douleur, de stimuler l’appétit ou de calmer les crises. En 2018, un médicament dérivé du cannabis – Epidiolex, composé de CBD purifié – a été approuvé pour contrôler les crises d’épilepsie chez certains patients. Certaines personnes atteintes de maladies graves, notamment la schizophrénie, le trouble obsessionnel compulsif, la maladie de Parkinson et le cancer, s’automédicamentent avec du cannabis en pensant que cela les aidera, et Mechoulam en voit la promesse. « Il y a beaucoup d’articles sur ces maladies et les effets du cannabis (ou de certains cannabinoïdes) sur elles. La plupart sont positifs », explique-t-il à Knowable Magazine.
Cela ne veut pas dire que la consommation de cannabis ne comporte aucun risque. M. Silva cite des recherches qui suggèrent que les consommateurs quotidiens de cannabis ont un risque plus élevé de développer des troubles psychotiques, en fonction de la puissance du cannabis ; un article a montré un risque 3,2 à 5 fois plus élevé. Les consommateurs chroniques de longue date peuvent développer le syndrome d’hyperémèse cannabique, caractérisé par des vomissements fréquents. Certains experts de la santé publique s’inquiètent de la conduite en état d’ébriété, et certaines formes récréatives de cannabis contiennent des contaminants tels que des métaux lourds aux effets néfastes.
Pour trouver des applications médicales aux cannabinoïdes, il faut comprendre leur pharmacologie et peser le pour et le contre.
M. Mechoulam a joué un rôle dans les premiers jours de la recherche sur les utilisations cliniques possibles du cannabis. S’appuyant sur des rapports anecdotiques remontant à l’Antiquité et faisant état de l’effet bénéfique du cannabis sur les crises d’épilepsie, lui et ses collègues ont étudié les effets du THC et du CBD sur l’épilepsie. Ils ont commencé par des souris et, comme le CBD ne présentait aucune toxicité ni aucun effet secondaire, ils sont passés à l’homme. En 1980, alors à l’Université hébraïque de Jérusalem, Mechoulam a co-publié les résultats d’un petit essai de 4,5 mois sur des patients épileptiques que les médicaments actuels n’aidaient pas. Les résultats semblaient prometteurs : Sur huit personnes prenant du CBD, quatre n’ont pratiquement pas eu de crises tout au long de l’étude, et trois ont vu une amélioration partielle. Un seul patient n’a pas été aidé du tout.
« Nous avons supposé que ces résultats seraient étendus par les entreprises pharmaceutiques, mais rien ne s’est produit pendant plus de 30 ans », écrit Mechoulam dans son article autobiographique. Ce n’est qu’en 2018 que la Food and Drug Administration américaine a approuvé l’Epidiolex pour le traitement des crises d’épilepsie chez les personnes atteintes de certaines maladies rares et graves. « Des milliers de patients auraient pu être aidés au cours des quatre décennies qui ont suivi notre publication initiale », écrit Mechoulam.
Le chimiste Raphael Mechoulam a fait un travail de pionnier dans les années 1960 en déterminant les structures chimiques des cannabinoïdes.
CRÉDIT : R. MECHOULAM / AR PHARMACOLOGIE ET TOXICOLOGIE 2023
L’approbation d’un médicament est un processus nécessairement long, mais pour le cannabis, il y a eu les obstacles supplémentaires des barrages juridiques, ainsi que la difficulté d’obtenir des protections par brevet pour les composés naturels. Ce dernier point fait qu’il est difficile pour une société pharmaceutique de justifier financièrement des essais humains coûteux et le long processus d’approbation de la FDA.
Dans la convention unique des Nations unies sur les stupéfiants de 1961, le cannabis a été classé dans les catégories les plus restrictives : l’annexe I (hautement addictive et susceptible d’abus) et son sous-groupe, l’annexe IV (avec des utilisations médicinales limitées, voire inexistantes). Les Nations unies n’ont retiré le cannabis de l’annexe IV qu’en décembre 2020 et, bien que le cannabis ait été légalisé ou décriminalisé dans plusieurs pays et dans la plupart des États américains, il figure toujours (de manière controversée) dans l’annexe I des États-Unis et des Nations unies, dans la même catégorie que l’héroïne. Le projet de loi américain sur la recherche sur le cannabis, adopté en décembre 2022, devrait permettre de résoudre certains problèmes liés à l’utilisation du cannabis et des cannabinoïdes en laboratoire.
À ce jour, la FDA n’a autorisé qu’une poignée de médicaments à base de cannabinoïdes, et jusqu’à présent, ils ne sont basés que sur le THC et le CBD. Outre l’Epidiolex, la FDA a approuvé le THC synthétique et un composé similaire au THC pour combattre les nausées chez les patients sous chimiothérapie et la perte de poids chez les patients atteints de cancer ou du sida. Mais il y a des indices de nombreuses autres utilisations possibles. Le registre des essais cliniques de l’Institut national de la santé (National Institutes of Health) répertorie des centaines de travaux en cours dans le monde entier pour étudier les effets des cannabinoïdes sur l’autisme, le sommeil, la maladie de Huntington, la gestion de la douleur, etc.
Selon M. Mechoulam, ces dernières années, l’intérêt s’est étendu, au-delà du THC et du CBD, à d’autres composés du cannabis comme le cannabigérol (CBG), que M. Mechoulam et son collègue Yehiel Gaoni ont découvert en 1964. Son équipe a fabriqué des dérivés du CBG qui ont des propriétés anti-inflammatoires et antidouleur chez les souris (par exemple, ils réduisent la douleur ressentie dans une patte enflée) et peuvent prévenir l’obésité chez les souris nourries avec des régimes riches en graisses. Un petit essai clinique sur les effets de la CBG sur le trouble d’hyperactivité avec déficit de l’attention est entrepris cette année. M. Mechoulam affirme que la forme ester méthylique d’un autre produit chimique, l’acide cannabidiolique, semble également « très prometteuse » – chez les rats, elle peut supprimer les nausées et l’anxiété et agir comme antidépresseur dans un modèle animal de trouble de l’humeur.
Mais si la liste des avantages possibles de tous les nombreux cannabinoïdes est énorme, le plus dur n’a pas encore été fait pour prouver leur utilité. « Il a été très difficile d’essayer de caractériser les effets de tous les différents cannabinoïdes », explique Sam Craft, un doctorant en psychologie qui étudie les cannabinoïdes à l’université de Bath, au Royaume-Uni. « La science n’a pas encore vraiment rattrapé tout cela ».
Une version naturelle dans notre corps
Si les cannabinoïdes ont des effets d’une telle portée, c’est en partie parce que, comme Mechoulam a contribué à le découvrir, ils font partie de la physiologie humaine naturelle.
En 1988, des chercheurs ont annoncé la découverte d’un récepteur cannabinoïde dans le cerveau des rats, le CB1 (les chercheurs en trouveront plus tard un autre, le CB2, et les cartographieront tous deux dans le corps humain). M. Mechoulam s’est dit qu’un tel récepteur ne pouvait exister que si le corps produisait ses propres substances chimiques semblables aux cannabinoïdes des plantes. Il se rendait à Tel Aviv pour acheter des cerveaux de porc vendus comme nourriture, se souvient-il, et les ramenait au laboratoire. Il a trouvé deux molécules ayant une activité semblable à celle des cannabinoïdes : l’anandamide (nommée d’après le mot sanskrit ananda qui signifie « félicité ») et le 2-AG.
Ces endocannabinoïdes, comme on les appelle, peuvent modifier notre humeur et affecter notre santé sans que nous nous approchions d’un joint. Certains spéculent que les endocannabinoïdes pourraient être responsables, en partie, des bizarreries de la personnalité, des troubles de la personnalité ou des différences de tempérament.
Des études animales et cellulaires laissent entendre que la modulation du système endocannabinoïde pourrait avoir un large éventail d’applications possibles, dans tous les domaines, de l’obésité et du diabète à la neurodégénérescence, aux maladies inflammatoires, aux problèmes gastro-intestinaux et cutanés, à la douleur et au cancer. Des études ont montré que les endocannabinoïdes ou des créations synthétiques similaires aux composés naturels peuvent aider des souris à se remettre d’un traumatisme cérébral, débloquer des artères chez des rats, combattre des bactéries résistantes aux antibiotiques dans des boîtes de Pétri et atténuer la dépendance aux opiacés chez les rats. Mais le système endocannabinoïde est compliqué et n’est pas encore bien compris ; personne n’a encore administré d’endocannabinoïdes à des personnes, ce qui laisse ce que Mechoulam considère comme un trou béant dans les connaissances, et une énorme opportunité. « Je crois que nous passons à côté de beaucoup de choses », dit-il.
« Il s’agit en effet d’un domaine de recherche sous-exploré », convient M. Silva, et il pourrait un jour déboucher sur des produits pharmaceutiques utiles. Pour l’instant, cependant, la plupart des essais cliniques sont axés sur la compréhension du fonctionnement des endocannabinoïdes et de leurs récepteurs dans notre organisme (y compris la manière dont tout, des probiotiques au yoga, affecte les niveaux de ces substances chimiques).
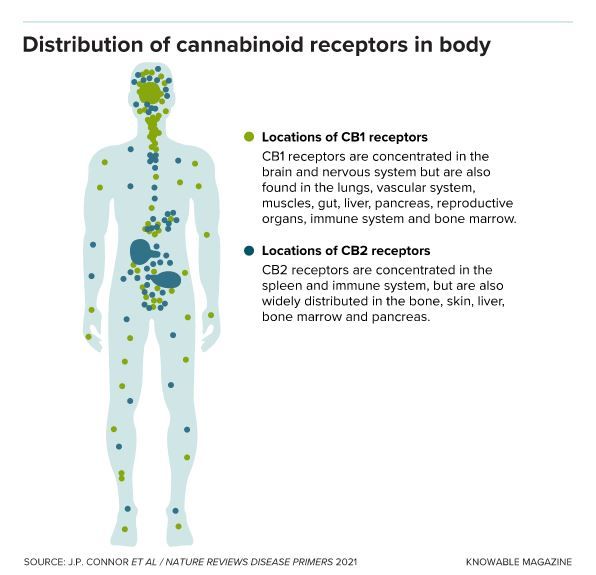
Les récepteurs cannabinoïdes CB1 et CB2 sont présents dans tout le corps, du cerveau à la rate. Les récepteurs CB1 sont particulièrement courants dans le système nerveux ; les récepteurs CB2 sont concentrés dans le système immunitaire et les zones connexes. Mais les deux récepteurs sont également présents dans tout le corps. Cette large distribution signifie que les composés – du THC aux endocannabinoïdes en passant par les cannabinoïdes synthétiques – qui se lient à l’un ou aux deux de ces récepteurs peuvent affecter une grande variété de systèmes, notamment la perception de la douleur, l’activité motrice, l’appétit et la mémoire à court terme.
Les « effets toxiques » des molécules synthétiques
Dans le sillage de la découverte des récepteurs CB1 et CB2, de nombreux chercheurs se sont concentrés sur la conception de nouvelles molécules synthétiques qui se lieraient à ces récepteurs encore plus fortement que les cannabinoïdes végétaux. Les sociétés pharmaceutiques s’efforcent de mettre au point de tels cannabinoïdes synthétiques depuis des décennies, mais jusqu’à présent, selon M. Craft, sans grand succès – et avec quelques ratés. Un médicament appelé Rimonabant, qui se lie étroitement au récepteur CB1 mais agit à l’encontre de l’effet habituel du CB1, a été approuvé en Europe et dans d’autres pays (mais pas aux États-Unis) au début des années 2000 pour aider à diminuer l’appétit et ainsi lutter contre l’obésité. Il a été retiré du marché mondial en 2008 en raison d’effets secondaires psychotiques graves, provoquant notamment des dépressions et des pensées suicidaires.
Certaines des substances synthétiques inventées à l’origine par des universitaires et des entreprises pharmaceutiques se sont retrouvées dans des drogues récréatives comme le Spice et le K2. Ces drogues sont en plein essor et de nouvelles formulations chimiques ne cessent de voir le jour : Depuis 2008, 224 composés différents ont été repérés en Europe. Ces composés, modifiés chimiquement pour maximiser les effets psychoactifs, peuvent provoquer des maux de tête, de la paranoïa, des palpitations cardiaques, une insuffisance hépatique et la mort. « Ils ont des effets très toxiques », dit Craft.
Pour l’instant, dit Silva, il y a peu de preuves que les cannabinoïdes synthétiques existants sont utiles en médecine : Au fur et à mesure que la plupart des candidats médicaments ont progressé dans le pipeline, des effets indésirables ont eu tendance à apparaître. C’est pourquoi, selon M. Silva, la plupart des efforts pharmaceutiques visant à développer des cannabinoïdes synthétiques ont été abandonnés.
Mais cela ne signifie pas que toutes les recherches ont été arrêtées ; un cannabinoïde synthétique appelé JWH-133, par exemple, est étudié chez les rongeurs pour sa capacité à réduire la taille des tumeurs du cancer du sein. Il est possible d’apporter des dizaines de milliers de modifications chimiques différentes aux cannabinoïdes, et donc, dit Silva, « il est probable que certaines de ces combinaisons puissent avoir un potentiel thérapeutique. » Le système endocannabinoïde est si important dans le corps humain qu’il y a beaucoup de place pour explorer toutes sortes d’angles médicinaux. Mechoulam siège par exemple au conseil consultatif de la société EPM, basée en Israël, qui vise spécifiquement à développer des médicaments basés sur des versions synthétiques de types de composés cannabinoïdes appelés acides cannabinoïdes synthétiques.
Avec tous ces travaux en cours sur la chimie de ces composés et leur fonctionnement dans le corps humain, Mechoulam, aujourd’hui âgé de 92 ans, voit une explosion à venir dans la compréhension de la physiologie du système endocannabinoïde. Et avec cela, dit-il, « je suppose que nous aurons beaucoup de nouveaux médicaments ».








